Dříve jsme objasnili, že I3C vyvolává BRCA1 expresi a že oba, jak I3C tak i BRCA 1, inhibují aktivitu estrogenem (E2) stimulovaného estrogenního receptoru (ER-α) v lidských rakovinných buňkách prsu. Nynější výsledky naší studie ukazují, že oba, jak I3C tak i genistein, vyvolávají expresi obou genů rizikových pro vznik rakoviny prsu (BRCA1 and BRCA2) v typech nádorových buněk prsu (MCF-7 and T47D) a prostaty (DU-145 and LNCaP), a to v závislosti na čase a dávce. Indukce BRCA genů se objevila při malých dávkách I3C (20 mM) a genisteinu (0.5–1.0 mM), což svědčí o potenciálním významu pro prevenci nádorového bujení. Kombinace I3C a genisteinu poskytla větší než očekávanou indukci BRCA exprese. Studie užívající malé interferující RNA kyseliny (siRNAs) a BRCA vektory exprese ukazují, že fytochemická indukce BRCA2 je částečně výsledkem BRCA1. Funkční studie ukazují, že cytotoxicita zprostředkovaná I3C je částečně závislá na BRCA1 a BRCA2. Inhibice aktivity E2 stimulovaného ER-α prostřednictvím I3C a genisteinu byla závislá na BRCA1; a inhibice aktivity ligandem indukovaného androgenního receptoru (AR) prostřednictvím I3C a genisteinu byla částečně revertována prostřednictvím BRCA1-siRNA. Závěrem poskytujeme důkaz, svědčící o tom, že fytochemická indukce BRCA1 exprese je částečně způsobená stresovou odpovědí endoplazmatického retikula. Tyto nálezy svědčí o tom, že BRCA geny jsou molekulárními cíly pro některé z aktivit I3C a genisteinu.
British Journal of Cancer (2006) 94, 407–426. doi:10.1038/sj.bjc.6602935 www.bjcancer.com
Published online 24 January 2006
© 2006 Cancer Research UK
Klíčová slova: indol-3-karbinol (I3C); genistein; chemoprevence; BRCA1; BRCA2; EMR; stresová odpověď endoplazmatického retikula
Indol-3-karbinol (I3C) je fytolátka nacházející se v brukvovité zelenině, jako je kapusta a květák. Epidemiologické studie ukazují závislost mezi dietou bohatou na takovou zeleninu a sníženým výskytem rakoviny prsu (Graham et al, 1982).
Ve studiích na zvířatech dieta bohatá na tuto zeleninu inhibovala nádory indukované chemickými karcinogeny a dietní suplementace I3C byla schopna předejít vzniku estrogen-dependentních tumorů (prsu, děložního čípku, endometria) (Bradlow et al, 1991; Kojima et al, 1994; Jin et al,1999). V klinických studiích I3C způsobil regresi intraepiteliální neoplazie děložního čípku (Bell et al, 2000) a regresi nebo snížení tempa růstu u opakovaných polypů hrtanu (Rosen et al,1998). Protinádorová aktivita indol-3-karbinolu je částečně přisuzována jeho antiestrogenní aktivitě: stimuluje 2-hydroxylaci a inhibuje 16α-hydroxylaci estronu vedoucí k vzniku inaktivních estronových metabolitů (Michnovicz and Bradlow, 1990). Indol-3-karbinol pravděpodobně také přímo vzájemně reaguje s estrogenovým receptorem (ER-α) a inhibuje jeho aktivitu (Jin et al, 1999) a spolupracuje s Tamoxifenem při inhibici proliferace nádorové buňky prsu (Cover et al, 1999).
Indol-3-karbinol se také uplatňuje v estrogen-nondependentních procesech. Může inhibovat progresi buněčného cyklu, indukovat apoptózu a inhibovat nádorovou invazi a metastazování, dokonce i v ER-α negativních buňkách (Meng et al, 2000a, 2001; Bonnesen et al, 2001; Chen et al, 2001). Indol-3-karbinol snižuje expresi G1 cyklin dependentní kinázy (CDK6) a zvyšuje CDK inhibitor (p21Cip1) (Cover et al, 1998). Hlavní aktivní metabolit I3C, diindolylmetan (DIM), indukuje expresi GADD45α – genu odpovědného za opravy DNA a domnělého nádorového supresoru (Carter et al, 2002). Indol-3-karbinol může aktivovat dvě cesty spojené s prevencí rakoviny: 1) signálování aryl hydrokarbonového receptoru (AhR) (což vede k expresi enzymatické fáze I (např. CYP1A1) cestou xenobiotické odpovědi prvku a 2) signálování antioxidant/elektrofilní odpověďi prvku (vedoucí k expresi fáze II detoxikujících enzymů: např. oxidoreduktáz a glutathion-S-transferáz) (Chen et al, 1998; Hayes and McMahon, 2001; Kwak et al, 2002). Schopnost I3C indukovat enzymy, které metabolizují genotoxické sloučeniny, tedy pravděpodobně přispívá k nádorové prevenci.
Schopnost I3C a DIM inhibovat růst lidských prostatických nádorových buněk zvýšila zájem o I3C v prevenci rakoviny prostaty. Z toho vyplývá, že DIM inhiboval dihydrotestosteronem (DHT) stimulovanou buněčnou proliferaci a DHT indukovanou aktivaci promotoru prostatického specifického antigenu v buňkách LNCaP tím, že působil jako AR antagonista (Le et al,2003). Indol-3-karbinol indukoval zástavu růstu upregulací inhibitoru G1 buněčného cyklu (p21Cip1 a p27Kip1) u androgen-nondependentních buněk rakoviny prostaty PC-3 (Chinni et al, 2001). Indol-3-karbinol a DIM mohou indukovat
*Korespondence: Dr EM Rosen;
E-mail: emr36@georgetown.edu
Revidováno 30.11. 2005; přijato 30. 11. 2005; publikováno online 24. 1. 2006
p53-nondependentní apoptózu u buněk rakoviny prostaty, a to částečně díky inhibici NF-kB a c-Akt signální dráhy (Chinni et al, 2001; Nacheson-Kedmi et al, 2003).
Prokázali jsme, že I3C upreguluje expresi susceptibilního genu-1 rakoviny prsu (BRCA1) (Meng et al, 2000a b, 2001; Carter et al, 2002). V tomto sdělení publikujeme, že : 1) jak I3C, tak genistein, sójový isoflavon s preventivní aktivitou proti růstu buněk nádorů prostaty a jiných typů nádorů zvyšuje aktivitu BRCA1 a BRCA2; 2) geny BRCA přispívají k funkčním aktivitám I3C a genisteinu a 3) indukce BRCA může být částečně způsobena stimulací stresového signálování endoplazmatického retikula. Tyto nálezy mají dopady na pochopení mechanismu(ů) působení těchto fytolátek uplatňujících se v prevenci rakoviny.
MATERIÁL A METODIKA
Zdroje reagencií
Indol-3-karbinol a genistein byly získány od firmy Sigma Chemical Co. (St Louis, MO, USA) a rozpuštěny v malém množství dimetylsulfoxidu (DMSO) rozředěním v buněčné kultuře. 17-b Estradiol a DHT byly rovněž získány od firmy Sigma. Thapsigargin a tunicamycin byly získány od Sigmy, rozpuštěny v DMSO a skladovány při -20°C.
Buněčné linie a kultury
Nádorové buňky rakoviny lidského prsu (MCF-7 and T47D) a prostaty (DU-145, PC-3, and LNCaP) byly získány ze sbírky American Type Culture Collection (Manassas, VA, USA). Všechny buněčné linie s výjimkou LNCaP byly pěstovány v Eaglově médiu s Dulbeccovou modifikací (DMEM) s 5% (MCF-7, DU-145, a PC-3) nebo 10% (T47D) (vvֿ¹) fetálním telecím sérem, L-glutaminem (5mM), neesenciálními amino kyselinami (5mM), penicilinem (100Umlֿ¹) a streptomycinem (100 µgmlֿ¹) (BioWhittaker, Walkersville, MD, USA). LNCaP buňky byly pěstovány v médiu RPMI 1640 s 10% fetálním telecím sérem a výše uvedenými aditivy. Byla použita standartní metodika pro pěstování buněčných kultur (Fan et al, 1998, 2001a, b).
Vektory exprese a reportérové plasmidy
Přirozená („wild type“, pozn. překl.) BRCA1 (wtBRCA1) cDNA, klonovaná do pcDNA3 vektoru exprese (Invitrogen), byla popsána dříve (Fan et al,1998). Pro expresi BRCA2, humánní BRCA2 cDNA v plné délce (poskytnutá Dr Qingshen Gao, New England Medical Center, Boston, MA, USA) byla klonovaná do pCMV-Tag2B vektoru (Stratagene). Humánní vektor exprese ER-α a estrogen responsivní reportér ERE-TK-Luc byly popsány dříve (Fan et al, 1999b, 2001a). Vektor „wild-type“ AR exprese pSG5-AR a androgen responsivní reportérový plazmid ARE-TK-Luc poskytl Dr. Chawshang Chang (University of Rochester, Rochester, NY, USA). ARE-TK-Luc reportér obsahuje upstream androgen responsivního prvku vztahujícího se k promotéru minimální thymidinové kinázy (TK), řídícího gen pro luciferázu.
Reportéry luciferázy řízené „wild type“ prvkem stresové odpovědi endoplazmatického retikula (ERSEwt-Luc), mutantní ERSE (ERSEmut-Luc, a negativní kontrola) a ERSE-II element (ERSEII3x-Luc) v pGL3 vektoru byly s laskavostí poskytnuty Dr. Kazutoshi Mori (HSP Research Institute, Kyoto Research Park, Kyoto, Japan) (Yoshida et al, 1998; Yamamoto et al, 2004). CHOP (C/EBP homologní protein) reportér promotéru luciferázy v pGL3 vektoru (CHOP-Luc) poskytl Dr. Pierre Fafournoux (Unite de Nutrition et Metabolisme Proteique, INRA de Theix, Saint Genes Champanelle, France) (Bruhat et al, 2000). Dominantní negativní (DN) PERK expresní vektor v pcDNA3 vektoru (DN-PERK) laskavě poskytla Dr. Annette C Dolphin (University College London, London, UK) (Page et al, 2004). DN-ATF4 vektor exprese poskytl Dr. Steve F Abcouwer (University of New Mexico School of Medicine, Albuquerque, NM, USA) (Roybal et al, 2004), zatímco DN-IRE1 vektor exprese poskytl Dr. David Ron (Skirball Institute of Biomolecular Medicine, New York University School of Medicine, New York, NY, USA) (Wang et al, 1998).
Analýzy buněčné viability (MTT)
Životaschopnost buňky byla určována následnými zpracováními popsanými v legendě, jak bylo popsáno dříve (Fan et al, 1998, 1999a). Pro zpracování siRNA byly subkonfluentní proliferující buňky byly transfektovány s BRCA1 nebo BRCA2 siRNA (50 nM x 72 h; viz níže) v 96 jamkové mikrotitrační destičce nebo simulovaně upravované (pouze s transfekčím činidlem), vystaveny různým dávkám I3C (nebo jen nosného media (DMSO)) na 24 h a poté zanalyzovány na MTT redukci. Pro pokusy s hyperexpresí byly buňky transfektovány přes noc s wtBRCA1 nebo wtBRCA2 expresními vektory (0.06 µg plazmidové DNA na 1 jamku), vymyty a postinkubovány po dalších 24 h, aby byla umožněna genová exprese, a to před expozicí I3C. Buněčná viabilita byla vyjádřena v porovnání s kontrolními buňkami vystavenými pouze DMSO (žádný I3C) jako průměr ±s.e.m. (standardní chyba průměru) z 10 replikačních jamek.
Knockdown BRCA1 nebo BRCA2 s použitím malých interferujících RNA kyselin (siRNAs)
BRCA1-siRNA a kontrolní (smíchaná sekvence) siRNA kyseliny byly popsány dříve (Xiong et al, 2003). Všechny siRNA kyseliny byly chemicky syntetizovány firmou Dharmacon, Inc. Pro zpracování s siRNA byly subkonfluentní proliferující buňky transfektovány s 50 nM siRNA za použití siPORT amino transfekčního činidla (Ambion). 72–hodinová inkubace se siRNA byla vyžadována jak pro BRCA1, tak pro BRCA2 pro dosažení maximální redukce hladiny proteinu. Předchozí studie ukázaly, že za těchto podmínek nezpůsobuje žádná ze siRNA kyselin cytotoxicitu, vztaženo na buněčnou morfologii a MTT analýzy. Sekvence používané k syntetizování siRNA kyselin jsou uvedeny níže:
BRCA1-siRNA 5′-AATGCCAAAGTAGCTAATGTA-3′
Kontrolní -siRNA 5′-CGATAGATACACAGATTGAAT-3′
BRCA2-siRNA 5′-AACTGAGCAAGCCTCAGTCAA-3′
Analýza transkripční aktivity estrogenního receptoru-α
Aktivita estrogenního receptoru-α byla měřena cestou transientních transfekčních analýz za použití estrogen-responsivního reportéru luciferázy (Fan et al, 1999b, 2001a). Stručně, subkonfluentní proliferující buňky byly kotransfektovány přes noc ve 24 jamkových titračních destičkách s „wild type“ ER-α expresním vektorem (pSG5-ER-α) a ERE-TK-Luc reportérem (0.25 µg v každém plazmidu na jamku), za přítomnosti Lipofectamine™ (Life Technologies, Carlsbad, CA, USA). Jamky byly vymyty k odstranění zbývajícího plazmidu a Lipofectamine, ponechány několik hodin v izolaci a postinkubovány na 24 h v médiu bez fenolové červeni obsahujícím 2% fetální telecí sérum čištěné dřevěným uhlím s uvedenými látkami (17-β-estradiol (E2, 1 βM) a/nebo I3C a/nebo genistein). Dávky každé látky jsou uvedeny v obrázcích. Aktivita luciferázy byla určena a hodnoty byly vyjádřeny relativně vztaženo k pozitivní kontrole (+ E2, žádný I3C nebo genistein) jako průměry ±s.e.m. (standardní chyba průměru) tří nezávislých pokusů, podmínka každé analýzy byla testována opakovaně ve čtyřech jamkách na pokus. K monitorování transfekční efektivity byly buňky kotransfektovány s kontrolním plazmidem pRSV-β-gal k umožnění měření aktivity β-galaktosidázy.
Analýzy transkripční aktivity androgenního receptoru (AR)
Aktivita androgenního receptoru byla měřena cestou transientních transfekčních analýz za použití androgen-responsivního reportéru (ARE-TK-Luc).
Analýzy byly provedeny tak, jak je popsáno výše, kromě toho AR negativní PC buňky byly kotranfekovány „wild type“ lidským AR expresním vektorem (pSG5-AR) a buňky byly stimulovány DHT (10 µM) na 24 h opět za absence nebo přítomnosti přesně stanovených dávek I3C nebo genisteinu. Exprese aktivity luciferázy a počet opakovaných analýz byly stejné, jak je popsáno výše. Každý pokus byl opakován nejméně dvakrát k zajištění reprodukovatelnosti.
mRNA analýzy
mRNA exprese byla určena pečlivě kontrolovanými semikvantitativními RT-PCR analýzami. Pro každý zesílený (amplifikovaný) výsledek byly podmínky PCR reakce a počty cyklů individuálně nastaveny tak, že všechny reakce se udály v rámci lineárního rozsahu umocnění výsledku. Detailní metody RNA izolace, cDNA syntéz a RT-PCR analýz pro BRCA1, BRCA2 a β-aktin (kontrolní gen) byly popsány dříve (Fan et al, 1998, 1999a; Xiong et al, 2003). Pro AR PCR úvody byly jak následuje: 5′- TTTTCCCCCTCTTCCTT-3′ (dopředu) a 5′- TCCTTTTTTCCAGCATAGACC-3′ (zpět). PCR výsledky byly analyzovány elektroforézou v 0,8% agarózních gelech obsahujících 0.1mgmlֿ¹ ethidium bromid, gely byly fotografovány pod ultrafialovým světlem. Hladiny mRNA byly kvantifikovány denzitometrií cDNA pruhů a vyjádřeny relativně k β-aktinu. Byly provedeny nejméně dva nezávislé pokusy pro každý pozorovaný buněčný typ.
Proteinové analýzy
Produkty buněčné lýzy byly připraveny a „Western blotting“ (oddělování proteinů elektroforézou) bylo provedeno tak, jak bylo popsáno dříve (Fan et al, 1998, 1999a). Stejné množství alikvotních částí z celkového buněčného proteinu (50 µg na pruh) bylo elektroforezováno na SDS-polyacrylamidových gradientních gelech, transferováno do nitrocelulosových membrán (Millipore, Billerica, MA, USA) a „blotted“ za použití těchto primárních protilátek: BRCA1 (C-20, polyklonální králičí, Santa Cruz Biotechnology, 1 : 200); BRCA2 (C-19, Santa Cruz, 1 : 200) a aktinu (I-19, polyklonální kozí, Santa Cruz, 1 : 500). Proteinové pásy byly vizualizovány za použití zvýšeného chemiluminescenčního systému (Amersham) s barvenými indikátory (BioRad) jako molekulárními standardy velikosti. Proteinové pásy byly kvantitativně vyjádřeny pomocí denzitometrie a hodnoty byly vyjádřeny relativně k aktinu (kontrola obsahu a přenosu). Byly provedeny nejméně dva nezávislé pokusy pro každý sledovaný buněčný typ.
Statistická srovnání
Tam, kde to bylo patřičné, byla statistická srovnání experimentálních výsledků provedena za použití dvouvýběrového Studentova t-testu.
Výsledky
Indol-3-karbinol upreguluje BRCA1 a BRCA2 expresi v rakovinných buňkách prsu a prostaty
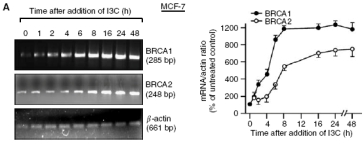
Dříve jsme ukázali, že I3C stimuluje BRCA expresi v lidských rakovinných buňkách děložního čípku a prsu (Meng et al, 2000a, b, 2001; Carter et al, 2002). V této studii jsme testovali efekt I3C na BRCA1 a BRCA2 expresi v rakovinných buňkách prsu a prostaty. Za použití přísně kontrolovaných semikvantitativních a denzitometrických analýz jsme zjistili, že dávka I3C (60 µM) s malou nebo žádnou cytotoxicitou způsobila časově závislé zvýšení hladin BRCA1 a BRCA2mRNA ve dvou buněčných rakoviných liních MCF-7 and T47D (obr. 1A and B). Hladiny BRCA1 byly zvýšeny v nejdříve testovaném časovém bodu (1 h), dosáhly přibližného maxima v průběhu 6-8 h a byly ještě zvýšeny za 48 h. Hladiny T47D, BRCA2 mRNA byly také zvýšeny v průběhu 1-2 h a zvýšení ptřetrvávalo po celou dobu experimentu. Buňky MCF-7 také vykazovaly silnou časově závislou indukci BRCA2 prostřednictvím I3C, ale konzistentně zvýšené hladiny BRCA2 mRNA byly pozorovány pouze za 6 h a později. Indol-3-karbinol způsobuje na dávce závislé zvýšení BRCA1 a BRCA2 mRNA (měřeno za 24 h) začínající na 20-40 µM (obr. 1C a D). V těchto pokusech byly evidentní malé nebo žádné změny v expresi kontrolního genu (β-aktinu).
Testovali jsme efekt I3C na hladiny BRCA proteinu za použití „Western blotting“ s kvantifikací proteinových pruhů denzitometrií. Hladiny BRCA proteinu byly upregulovány prostřednictvím I3C v závislosti na čase a dávce v typu rakovinných buněk prsu (MCF-7 and T47D) a prostaty (LNCaP and DU-145) (obr. 2). Zvýšení hladin BRCA2 proteinu v rakovinných buňkách prsu bylo poprvé pozorováno po 4-8 h při I3C (6O µM), zatímco zvýšení hladin BRCA1 bylo detekováno dříve, ale jejich nárůst byl relativně nízký v časných fázích (obr. 2a a B). Studie dávka-odpověď MCF7 a T47D buněk ukázaly signifikatní indukci (>2násobně) hladin proteinu BRCA1 a BRCA2 pri nejnižší testované dávce I3C, 20 µM (obr. 2C a D.) Na obrázku 2C indukce proteinu BRCA2 není taková jako indukce mRNA (obr. 1C). Může to být díky nepřesnostem denzitometrického stanovení množství RT-PCR (speciálně pokud jsou pruhy slabé), díky faktu, že proteinové a mRNA pokusy byly prováděny v různých časech nebo díky faktu, že I3C měl možná dodatečný efekt na proteinovou stabilitu, což nemůžeme vyloučit.
Studie časového průběhu buněčných linií rakoviny prostaty ukázaly zpoždění v indukci BRCA2 s použitím I3C (první pozorováno v 6h) ve srovnání s BRCA1 (1h) (obr. 2E a F). Pokud jde o buňky rakoviny prsu, BRCA1 a BRCA2 hladiny byly zvýšeny prostřednictvím ≥ 2násobku nejnižší dávky I3C (20 µM) (obr. 2G a H). Ačkoliv se vyskytlo několik odlišností mezi jednotlivými buněčnými liniemi, tyto studie ukazují reprodukovatelnou indukci úrovní proteinu BRCA1 a BRCA2 prostřednictvím I3C s nárůsty hladin proteinu BRCA1 a BRCA2 v dávce I3C 60 µM za 24 h 5-10násobku pro buněčné linie rakoviny prsu a 8-16násobku pro buněčné linice rakoviny prostaty. Poznámka: Ve studiích ukázaných v obrázcích 1 a 2 jsou hodnoty denzitometrie průměry nejméně dvou nezávislých pokusů.
Genistein upreguluje expresi BRCA1 a BRCA2
Genistein je sójový izoflavon, který funguje částečně jako fytoestrogen a fytoandrogen (Wang et al, 1996; Maggiolini et al, 2002). Od té doby, co je genistein navrhován jako chemopreventivní činidlo pro několik typů tumorů včetně rakoviny prsu a prostaty, jsme testovali jeho schopnost indukovat expresi BRCA. Genistein způsobil na dávce a čase závislá zvýšení hladin BRCA1 a BRCA2 proteinů ve dvou estrogen-responsivních buněčných liniích rakoviny prsu (MCF-7 and T47D) (obr. 3D). Indukce BRCA 1 se objevila po 1 h od expozice genisteinu (5 µM), zatímco indukce BRCA2 byla zpožděna až do 6-8 h (obr. 3A a B). Pro obě buněčné linie byla zvýšení hladin BRCA1 >2násobně pozorována v nejnižší dávce testovaného genisteinu (0.5 µM), zatímco podobně silná zvýšení hladin BRCA2 vyžadovala vyšší dávky genisteinu (1-2.5 µM) (obr. 3C a D).
Genistein také způsobil na čase a dávce závislá zvýšení hladin BRCA v androgen-senzitivních (LNCaP) a nesenzitivních (DU-145) buňkách rakoviny prostaty. Pro tyto buněčné linie se zvýšení hladin BRCA1 ≥ 2násobně objevila za 1 h, zatímco podobná zvýšení hladin BRCA2 se objevila za 4-8 h (obr. 3E a F). Pokud bylo měřeno za 24 h, signifikatní zvýšení hladin BRCA1 vyžadovala dávky 0.5-1.0 µM, zatímco zvýšení hladin BRCA2 vyžadovala 2.5 µM genisteinu (obr. 3G a H). Zvýšení hladin BRCA po vystavení až 5 µM genisteinu byla v rozmezí 4-12násobně vyšší pro buňky rakoviny prsu a 5-17násobně vyšší pro rakovinné buňky prostaty. Hodnoty denzitometrie na obrázku 3 jsou průměry nejméně dvou nezávislých pokusů.
Kompletní zprávu můžete stáhnout zde: BRCA1 a BRCA2.doc